Rhomboidprotease-Wirkungsmechanismus enthüllt
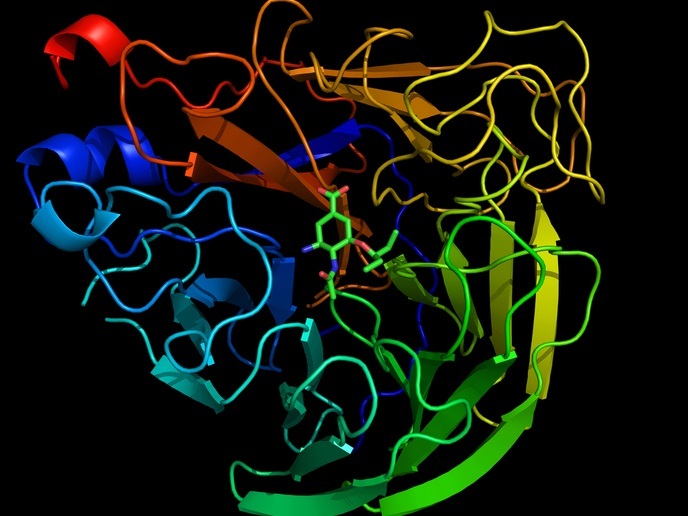
Proteine der Rhomboidfamilie an Intramembranproteasen sind für ihre wichtige biologischen Funktionen bekannt, die unter anderem die intrazelluläre Signalgebung, die mitochondriale Dynamik und die Invasion eukaryotischer Parasiten betreffen. Im Hinblick auf den Funktionsmechanismus bei Säugetieren und Bakterien ist jedoch trotz aktueller Daten zu den Kristallstrukturen prokaryotischer Intramembranproteasen nur wenig bekannt. Die Ursache hierfür ist in erster Linie ein Mangel an Informationen über Rhomboid-Protease-Substratkomplexe. Um die Funktion dieser Enzyme zu beleuchten, untersuchten die Wissenschaftler des Projekts RHOMBOID SUBSTRATES mithilfe einer Kombination aus fortschrittlicher Substratspezifitätsanalyse, quantitativer Proteomik und Genetik deren natürliche Substrate. Die identifizierten Substrate halfen dem Konsortium dabei, die Mechanismen zu enthüllen, die der biologischen Funktion bestimmter Rhomboidproteasen in menschlichen Epithelzellen und in Modellbakterien zugrunde liegen. Neue Substrate tragen zur Skizzierung des Rhomboidsubstrat-Wirkungsmechanismus bei. Die Arbeit an E.coli- und B.subtilis-Rhomboidproteasen offenbarte, dass sie ähnlich der ER-assoziierten Degradation, die von eukaryotischen Zellen bekannt ist, die Qualitätskontrolle bei Membranproteinen sicherstellen. Im Hinblick auf die Rhomboidproteasen bei Säugetieren waren die Maßnahmen auf RHBDL2 fokussiert, eines von vier bekannten Enzymhomologen, die sich im sekretorischen Weg befinden. RHBDL2 lagert sich an die Plasmamembran an, wo es über die Katalisation der Proteolyse von transmembranen Zelloberflächenproteinen als Sekretase wirkt. Forscher griffen zur Identifizierung des Repertoires an RHBDL2-Substraten auf quantitative Proteomik zurück. Es wurden verschiedene neue Moleküle untersucht, die speziell durch RHBDL2 gespalten werden. Dies schloss den Rezeptor Interleukin-6, den Zelloberflächeninhibitor Spint-1, die Kollagenrezeptortyrosinkinase DDR1, N-Cadherin und weitere Moleküle ein. Diese Substrate zeigten interessanterweise eine hohe Spezifität, da sie lediglich durch RHBDL2 und durch keine anderen Rhomboidparaloge gespalten werden konnten. Das Team enthüllte die Grundprinzipien der Substraterkennung durch Rhomboidproteasen und löste die allererste Struktur eines Komplexes, der aus einer Intramembranprotease mit Substrat-basierten Peptiden bestand. „Dies ermöglichte es uns, innovative, hochsensitive und vielseitige Aktivitätsassays zu entwickeln und führte uns, was noch wichtiger ist, zur Entdeckung einer neuen Klasse von Rhomboidproteaseinhibitoren, die in bislang unerreichter Weise potent und selektiv sind und die einer klaren Logik bezüglich der Modifikation ihrer Selektivität folgen“, erklärt Projektkoordinator Prof. Strisovsky. Die identifizierten Stoffe stellen die ersten Werkzeuge zur Untersuchung der biologischen Funktion von Rhomboidproteasen dar, sie könnten jedoch auch als pharmazeutische Inhibitoren dieser Enzyme fungieren. Die klinische Signifikanz von Rhomboidproteasen Die klinische Signifikanz von Rhomboidproteasen steckt noch in ihren Anfängen. „Eine Analyse der Genexpression von RHBDL2 und unserer am umfassendsten charakterisierten Substrate verdeutlicht, dass sie in den Epithelien der Haut, der Atemwege und des Verdauungstrakts stark exprimiert werden und unter ähnlichen pathologischen Bedingungen Veränderungen in ihrer Expression zeigen“, fährt Prof. Strisovsky fort. Manche der identifizierten Substrate scheinen zum Erhalt der epithelialen Homöostase beizutragen, ein komplexer Prozess, der eine Regulation der Zelladhäsion, Migration und sensorische Erfassung der extrazellulären Umgebung erforderlich macht. In Anbetracht der Tatsache, dass eine gestörte epitheliale Homöostase charakteristisch für eine Vielzahl von Erkrankungen wie z. B. Krebs, Entzündungen und Fibrosen ist, könnte Rhomboidproteasen neue therapeutische Bedeutung zukommen. Zu zusätzlichen Beispielen für Rhomboidproteasen mit klinischem Potential zählt das Plasmodium-falciparum-Homolog PfROM4. Die Hemmung des für die Infektiosität des Parasiten erforderlichen Homologs könnte eine antimalariale Wirkung zeigen. Die menschliche mitochondriale Rhomboidprotease PARL wirkt zudem als negativer Regulator der mitochondrialen Degradation. Da die Pathogenese der Parkinson-Krankheit mit der Ansammlung beschädigter Mitochondrien in Verbindung gebracht wird, könnte die Steigerung der mitochondrialen Autophagie durch PARL-Hemmung eine neuroprotektive Wirkung zeitigen. In der Gesamtbetrachtung bringen die Erkenntnisse und Ergebnisse des Projekts RHOMBOID SUBSTRATES das bestehende Wissen voran und es wird ein besseres Verständnis der physiologischen Bedeutung dieser wichtigen Enzyme ermöglicht.