Umprogrammierung des Immunsystems gegen Diabetes
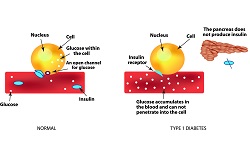
Gegenwärtig sind mehr als eine halbe Million Europäer von Typ-1-Diabetes betroffen, einer Krankheit, für die es noch keine Heilung oder Prävention gibt. Dabei schreitet die Zerstörung der insulinproduzierenden Beta-Zellen langsam voran, und meist wird zum Zeitpunkt der Diagnose noch eine Restmenge an Insulin produziert. Eine Langzeitstudie zu Diabeteskontrolle und Komplikationen (Diabetes Control and Complications Trial, DCCT) zeigte, dass Personen mit Restinsulin bessere Blutzuckerwerte und ein geringeres Risiko für Unterzuckerung wie auch Langzeitkomplikationen haben. Die Standardmethode in der Diabetologie ist die Insulintherapie, um den Insulinmangel auszugleichen. Da die Strategie aber ineffizient ist, könnte der Erhalt selbst geringster Mengen an endogen produziertem Insulin eine Alternative sein, um die Blutzuckerwerte zu stabilisieren. Dies vermeidet nicht nur Hypoglykämie, sondern auch Langzeitkomplikationen wie Sehstörungen, Nierenversagen und Fußgeschwüre. Das EU-finanzierte Projekt EE-ASI(öffnet in neuem Fenster) wendete daher eine epidermale antigenspezifische Immuntherapie (enhanced epidermal antigen specific immunotherapy, EE-ASI) an, mit der das Immunsystem neu programmiert wird und die Betazellen in der Bauchspeicheldrüse nicht mehr angreift. Das innovative Prinzip besteht darin, dem Körper auf funktionalisierten Goldnanopartikeln Peptide von Betazellen zu präsentieren. Projektkoordinator Prof. Dayan erklärt hierzu: "Eine effiziente Aufnahme der Nanopartikel in die dendritischen Zellen sorgt dafür, dass das Peptid im nicht-inflammatorischen Kontext präsentiert wird, was wiederum die Bildung regulatorischer T-Zellen fördert." Eine zweites (Immuntoleranz erzeugendes) Tolerogen wie Interleukin-10 soll neben dem Antigen die regulatorische T-Zell-Produktion fördern. Verteilung der Nanopartikel Prinzipiell ähnelt die EE-ASI-Methode einer Impfung, unterscheidet sich allerdings dadurch, dass die Autoimmunreaktion durch Aktivierung regulatorischer T-Zellen ausgeschaltet wird. Normalerweise erkennen T-Zellen körpereigene Proteine und verhindern, dass sie vom Immunsystem angegriffen werden. Das Projekt EE-ASI erzeugte hocheffiziente Goldnanopartikel und funktionalisierte sie mit dem Proinsulinpeptid C19-A3. "Gold ist nahezu inert und wirkt entzündungshemmend, was hier vorteilhaft ist", fährt Prof. Dayan fort. Die peptidbeladenen Nanopartikel wurden mit Mikronadeln ex vivo in die menschliche Haut injiziert, diffundierten in die Epidermis und wurden dann von den Langerhans-Zellen aufgenommen. Der Durchmesser der NP lag bei fünf Nanometern, da größere Partikel nicht mehr diffundieren. Vorklinische Experimente an Mäusen belegten, dass die NP schneller zu entfernten Lymphknoten diffundierten als das Peptid allein. Nachdem die Sicherheit der Methode toxikologisch bestätigt war, konnte in weniger als vier Jahren nach Projektbeginn ein Patent angemeldet und eine klinische Phase-I-Studie durchgeführt werden. Klinische Wirksamkeit EE-ASI ist die erste klinische Studie hierzu am Menschen und zeigt, wie ein an Nanopartikel konjugiertes Proinsulinpeptid im Körper wirkt. Den Ergebnissen zufolge verbleiben die Gold-NP bei intradermaler Verabreichung zusammen mit einem lokalen Lymphozyteninfiltrat länger als sechs Monate in der Haut, was noch näher untersucht werden soll. Weitere Studien werden zeigen, ob das Peptid am Gold-NP haften bleibt. Schließlich untersuchte das Konsortium andere tolerogene Moleküle sowie die Gabe von DNA-Molekülen, die körpereigene Peptide in der Haut exprimieren", betont Prof. Dayan. Obwohl Wirksamkeitsstudien noch ausstehen, scheint der Ansatz bei Typ-1-Diabetikern effektiv das Immunsystem anzuregen, körpereigene insulinproduzierende Zellen zu erkennen und die Zerstörung zu stoppen. Die einfache Anwendung der EE-ASI stellt bessere Compliance und weniger Komplikationen als eine Hormonersatztherapie in Aussicht, was wiederum das klinische Ergebnis und die Lebensqualität von Patienten und Angehörigen verbessern dürfte.