Un nouveau médicament pousse le SARM dans ses derniers retranchements
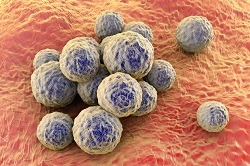
Au cours des années, Staphylococcus aureus, et plus particulièrement sa forme résistant à la méticilline (SARM), est devenu l'une des conséquences les plus tristement célèbres de l'hospitalisation. Sa forme «Community-Acquired» (CA-SARM) est devenue encore plus dangereuse et virulente, affectant des personnes en bonne santé, particulièrement en Amérique du Nord. En général, la maladie reste localisée à la peau et aux tissus mous. Elle provoque des abcès locaux pouvant être traités avec les antibiotiques auxquels le SARM est encore sensible: la vancomycine ou la rifampicine. Mais dans certains cas, le SARM dégénère en maladie mangeuse de chair (fasciite nécrosante) et, lorsqu'elle finit par accéder au système sanguin, il se diffuse dans tout le corps. Dans de tels scénarios, le taux de mortalité grimpe à 30 %. «Le SARM est considéré comme un 'super microbe' en raison de sa résistance aux antibiotiques, mais je l'appelle ainsi pour une autre raison: sa capacité à échapper aux réponses immunitaires innées», déclare le Dr Bas Surewaard, qui a coordonné le projet PMS-IN-INFLAMMATION pour l'UMC d'Utrecht. «Staphylococcus dispose d'un arsenal impressionnant de facteurs de virulence qui lui donnent la capacité de tuer et / ou d'échapper à toute cellule immunitaire dans le corps. Même lorsqu'il est absorbé par les phagocytes, qui détruisent facilement la plupart des bactéries, le SARM dispose de plusieurs mécanismes lui permettant de résister à cet environnement hostile et même de s'y reproduire.» Cela signifie qu'aucun vaccin ne peut éradiquer le SARM et qu'il est nécessaire de mieux connaître ses facteurs de virulence. Il est intéressant de constater que seul un nombre relativement faible de facteurs de virulence ont été associés à CA-SARM. Les modulines phénol-soluble (PSM) sont l'un d'entre eux, et le Dr Surewaard a initialement cherché à analyser ses fonctions. Il a pour cela employé une nouvelle technique de pointe appelée microscopie intravitale confocale à disque rotatif (SD-IVM), qui peut être utilisée pour suivre en temps réel la réponse immunitaire aux bactéries de souris anesthésiées vivantes. «Cette technique est extrêmement puissante car elle permet d'observer la réponse immunitaire dans des animaux vivants, à l'endroit et au moment où elle se produit. Malheureusement, notre objectif initial, qui était d'étudier par l'imagerie le rôle des PSM dans les infections de la peau, a été trop difficile à poursuivre car le collagène et la graisse nous ont empêchés d'obtenir des données pertinentes par SD-IVM. Notre attention s'est alors tournée vers la bactériémie à staphylocoque et ses conséquences sur le foie», explique le Dr Surewaard. Lorsqu'il a injecté le SARM dans le flux sanguin, le Dr Surewaard a constaté que 90 % des bactéries étaient capturées par un macrophage spécialisé situé dans le foie: la cellule de Kupffer. Il a donc orienté ses efforts de recherche de façon à déterminer si ces bactéries survivent dans les cellules de Kupffer ou si elles sont tuées, et quel est le mécanisme à l'origine du phénomène. «Nous avons constaté que 90 % des SARM ingérés par les cellules de Kupffer étaient éliminés dans les 8 premières heures de l'infection par l'intermédiaire d'une réactif oxydant. Mais les 10 % restants sont capables de résister à l'attaque des cellules de Kupffer et commencent à se dupliquer à l'intérieur de celles-ci. Ici, ils sont protégés contre les antibiotiques de dernier recours tels que la vancomycine. C'est ce qui pourrait expliquer pourquoi les patients en clinique doivent suivre des traitements à la vancomycine d'une durée de deux à six semaines, alors que les bactéries sont tuées en quelques heures dans un tube à essai», explique le Dr Surewaard. Il s'est alors demandé comment les antibiotiques pourraient être administrés à l'intérieur de ces cellules. La solution est venue de liposomes (gouttelettes lipidiques) enfermés dans la vancomycine, que le Dr Sureward a appelés vancosomes. Ces vancosomes étaient absorbées efficacement par les cellules de Kupffer, tuant les SARM résidant en leur sein et empêchant les bactéries de se propager à d'autres organes. Si ces vancosomes doivent être considérés comme une «preuve de principe», le Dr Surewaard collabore avec le Centre pour la recherche et le développement de médicaments (CDRD) à Vancouver au Canada, afin de mettre au point et commercialiser de nouvelles formulations à base de liposomes et de nanoparticules pour administrer plus efficacement les antibiotiques dans les cellules de Kupffer. En définitive, il espère que ses recherches permettront de guérir les patients atteints de maladies à staphylocoques et qu'elles convaincront la communauté scientifique de l'existence de SARM intracellulaires et de la nécessité de les éradiquer.