Fortschritte bei der Behandlung des malignen Glioms
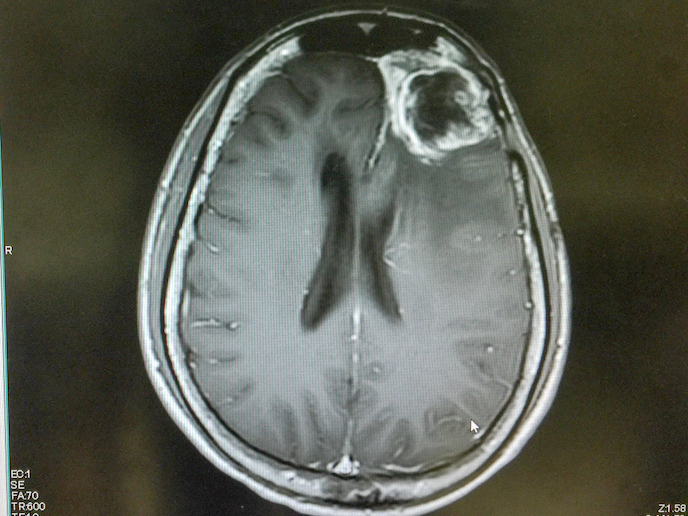
Das Glioblastom ist ein seltener, hochaggressiver Hirntumor mit sehr hoher Sterblichkeitsrate. Trotz Behandlung liegt die durchschnittliche Überlebenszeit meist nur bei 15 Monaten. LAM561(öffnet in neuem Fenster) ist ein vielversprechender, vom Unternehmen Laminar Pharma(öffnet in neuem Fenster) entwickelter Wirkstoff, der diesem medizinischen Bedarf nun besser Rechnung tragen soll. Das bioaktive Lipid LAM561 wird in die Oberflächenlipide der Tumorzellen eingeschleust, sodass mehr Membranflüssigkeit produziert wird und wichtige, für das Tumorwachstum verantwortliche Signalproteine entfernt werden. Auf diese Weise kann das Lipid in die Zelle eindringen, um die Enzymaktivität zu regulieren, die Membranzusammensetzung der gesamten Zelle zu verändern und tumorassoziierte Lipidflöße aufzulösen. Unterstützt durch das EU-finanzierte Projekt CLINGLIO(öffnet in neuem Fenster) könnte die neue Strategie nach der Erstdiagnose des Glioblastoms zur Verbesserung der Lebensqualität und längerer Lebenserwartung beitragen.
Unerwartete Herausforderungen
Projektschwerpunkt war der Nachweis von Sicherheit und Wirksamkeit des Wirkstoffs LAM561 innerhalb der etablierten Standardversorgung (Kombinationstherapie aus Bestrahlung und Temozolomid), was in einer multizentrischen internationalen klinischen Studie getestet wurde. So sollte die Studie die Belege erbringen, um bei der Europäischen Arzneimittel-Agentur(öffnet in neuem Fenster) (EMA) die bedingte Marktzulassung zu beantragen. LAM561 könnte damit in die Standardversorgung aufgenommen werden, sobald bestätigt ist, dass es in Ergänzung bisheriger Therapien die Tumorprogression signifikant verlangsamt. Doch wie so häufig bei komplexen klinischen Studien war auch hier die Durchführung schwieriger als erwartet. Vor Studienbeginn forderte die EMA z. B. eine vorläufige Phase-1b-Studie an, um das hohe Sicherheitsprofil und die optimale Dosis von LAM561 für die kombinierte Strahlen- Temozolomidtherapie zu bestätigen. Doch obwohl dies die Projektdurchführung zunächst verzögerte, lieferte es doch eines der wichtigsten Ergebnisse: die bestätigte Sicherheit von LAM561 im Rahmen der Standardversorgung des Glioblastoms.
Das Beste aus einer schwierigen Situation machen
Nun war zwar die Vorbereitung der klinischen Phase II/III-Studien abgeschlossen, eine weitere Hürde waren jedoch die Einschränkungen durch die COVID-19-Pandemie. Aber auch aus dieser Situation wurde das Beste gemacht. So konzentrierte sich das Gemeinschaftsunternehmen(öffnet in neuem Fenster) zunächst auf kontrollierbare Bereiche wie Vorbereitung der Markteinführung und Veröffentlichung von Forschungsbeiträgen zu LAM561 in renommierten wissenschaftlichen Fachzeitschriften. Weiterhin wurde ein neues Packungsformat für das Arzneimittel entworfen. So sollen Sachets statt Glasflaschen eine komfortablere, effizientere und nachhaltigere Anwendung vereinfachen.
Beginn der klinischen Studie
Nach den größtenteils aufgehobenen COVID-Beschränkungen kann Laminar Pharma nun die klinischen Phase II/III-Studien zur Wirksamkeit von LAM561 fortsetzen, für die Ende 2023 erste Zwischenergebnisse erwartet werden. „Die Studien werden zeigen, dass LAM561 verträglicher und wirksamer ist als bisherige therapeutische Ansätze“, sagt Victoria Llado von Laminar Pharma. „Und dies wäre nicht nur eine hervorragende Nachricht für ein kleines Biotechnologieunternehmen wie Laminar, sondern vor allem auch für die Betroffenen.“