Postępy w leczeniu pacjentów z glejakiem złośliwym
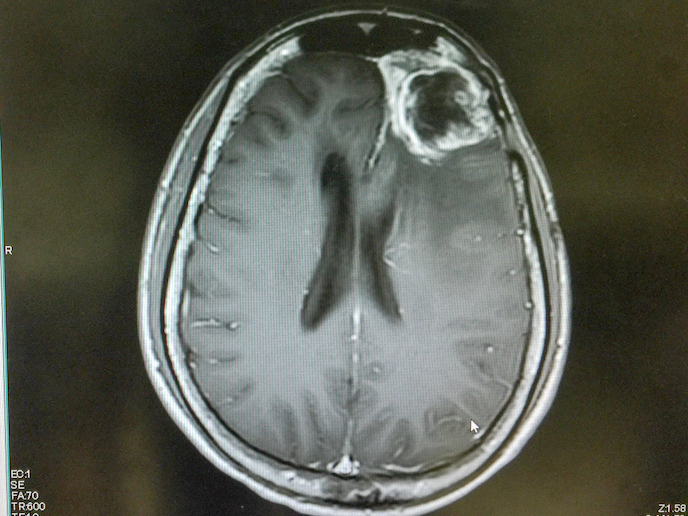
Glejak wielopostaciowy to rzadki i niezwykle agresywny rodzaj nowotworu mózgu charakteryzujący się wysoką śmiertelnością. Średnia przeżywalność większości pacjentów poddawanych leczeniu wynosi jedynie 15 miesięcy. Jednak nowy obiecujący związek opracowany przez Laminar Pharma(odnośnik otworzy się w nowym oknie) zwany LAM561(odnośnik otworzy się w nowym oknie) może rozwiązać tę kwestię. LAM561 to bioaktywny lipid, który wprowadzany jest do lipidów powierzchniowych komórek nowotworowych, zwiększając płynność błony i rozproszenie kluczowych białek sygnalizacyjnych odpowiedzialnych za rozprzestrzenianie się guza. Dzięki temu lipid może przeniknąć do komórki i regulować aktywność enzymów, zmieniając skład błony całej komórki i rozpuszczając związane z nowotworem tratwy lipidowe. Dzięki wsparciu finansowanego przez UE projektu CLINGLIO(odnośnik otworzy się w nowym oknie) ta nowatorska metoda leczenia pacjentów z nowo zdiagnozowanym glejakiem może w przyszłości przyczynić się do poprawy jakości i wydłużenia długości życia pacjentów.
Niespodziewane wyzwania
Głównym celem projektu było wykazanie bezpieczeństwa i skuteczności związku LAM561 w ramach ustalonego standardu leczenia (radioterapia plus temozolomid). Aby tego dokonać, badacze zainicjowali wieloośrodkowe, międzynarodowe badanie kliniczne. Jego celem było przeprowadzenie oceny koniecznej do złożenia wniosku o warunkowe dopuszczenie do obrotu przez Europejską Agencję Leków(odnośnik otworzy się w nowym oknie) (EMA). LAM561 mógłby stać się częścią standardu leczenia, jeśli jego włączenie do obecnych terapii znacząco opóźni progresję guza. Jednak jak to często bywa w przypadku złożonych badań klinicznych, ich realizacja okazała się trudniejsza niż zakładano. Na przykład zanim badacze mogli rozpocząć prace, musieli przedstawić EMA wyniki wstępnego badania fazy 1b, które stanowiło potwierdzenie profilu wysokiego bezpieczeństwa i pomogło w dobraniu najbardziej odpowiedniej dawki LAM561 stosowanej w połączeniu z radioterapią i temozolomidem. Chociaż to dodatkowe badanie opóźniło realizację projektu, pozwoliło osiągnąć jego najważniejszy cel: potwierdzenie bezpieczeństwa LAM561 w ramach standardowego leczenia glejaka.
Kiedy życie daje ci cytryny…
Zanim zespół mógł przejść do badań klinicznych fazy II i II, niespodziewanie napotkał na kolejne wyzwanie. Tym razem była to pandemia COVID-19. Jednak i tym razem zespół projektu CLINGLIO wziął sprawy w swoje ręce i obrócił sytuację na swoją korzyść. Konsorcjum(odnośnik otworzy się w nowym oknie) skupiło się na obszarach pozostających pod jego kontrolą, takich jak przygotowanie do możliwej komercjalizacji i promowanie LAM561 poprzez publikację artykułów we wpływowych czasopismach naukowych. Zespół opracował także nowy format opakowania leku. Szklane butelki zastąpiono saszetkami, które są wygodniejsze, bardziej wydajne i zrównoważone.
Realizacja badań klinicznych
W związku ze zniesieniem większości obostrzeń Laminar Pharma kontynuuje teraz niezbędne badania kliniczne fazy II/III, spodziewając się wyników pośrednich dotyczących skuteczności LAM561 pod koniec 2023 roku. „Mamy nadzieję, że badania te wykażą, że LAM561 jest lepiej tolerowanym i skuteczniejszym podejściem terapeutycznym od tych dostępnych obecnie”, mówi Victoria Llado z Laminar Pharma. „Byłaby to dobra wiadomość nie tylko dla małej firmy biotechnologicznej, jaką jest Laminar, ale przede wszystkim dla samych pacjentów”.