Wgląd w mechanizmy regulacji tłuszczu: wpływ na przewlekłe choroby wątroby
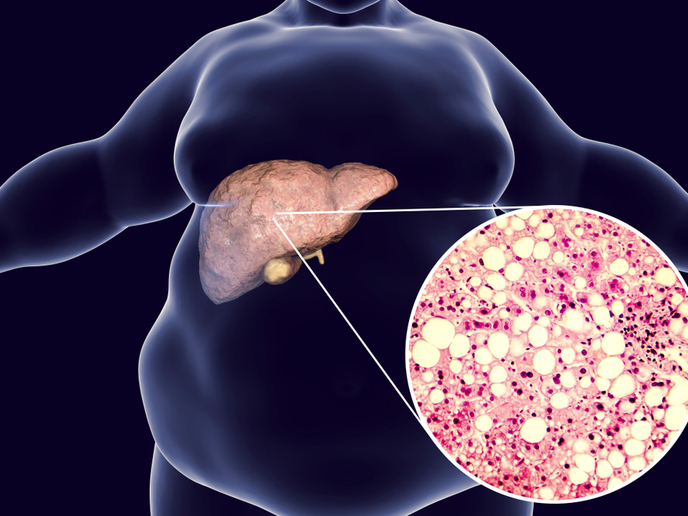
Wątroba to główny narząd kontrolujący homeostazę lipidów i metabolizujący kwasy tłuszczowe w triacyloglicerole(odnośnik otworzy się w nowym oknie) (TG). Hepatocyty pakują niewielkie ilości TG w organelle zwane kroplami lipidowymi, a ciało metabolizuje z nich TG, kiedy jest to wymagane w celu utrzymania poziomu lipidów i sprostania zapotrzebowaniu metabolicznemu. Zdolność do magazynowania TG i utrzymania wewnętrznego stabilnego poziomu lipidów decyduje o przetrwaniu w przypadku ograniczonej ilości składników odżywczych. Jednak zwiększone spożycie energii w połączeniu z obniżonym wydatkowaniem prowadzi do rozwoju kilku powszechnych zaburzeń metabolicznych, w tym otyłości i cukrzycy typu 2. To z kolei może wywołać niealkoholowe stłuszczeniowe zapalenie wątroby(odnośnik otworzy się w nowym oknie) (ang. non-alcoholic fatty liver disease, NAFLD) – przewlekłą chorobę związaną z wysokim nagromadzeniem triacylogliceroli wątrobowych. Z uwagi na poważne powikłania związane z NAFLD, takie jak niealkoholowe stłuszczeniowe zapalenie wątroby(odnośnik otworzy się w nowym oknie) (ang. non-alcoholic steatohepatitis, NASH) i marskość wątroby, zbadanie mechanizmów przyczyniających się do nagromadzenia lipidów w wątrobie ma kluczowe znaczenie.
Wgląd w najważniejsze enzymy zaangażowane w biosyntezę lipidów
Naukowcy z projektu TGDNL starali się zrozumieć, jak komórki regulują i koordynują magazynowanie lipidów w celu osiągnięcia homeostazy energii. Przeprowadzone dzięki wsparciu z działania „Maria Skłodowska-Curie” badanie skupiało się na zależności pomiędzy magazynowaniem energii a biosyntezą. „Ustalenia zespołu projektu TGDNL mogą przyczynić się do powstania nowych strategii terapeutycznych dla chorób charakteryzujących się zaburzonym magazynowaniem lipidów”, wyjaśnia stypendysta Mikael Rydén. Projekt TGDNL realizowany był we współpracy z Robertem Farese i Tobiasem Waltherem(odnośnik otworzy się w nowym oknie) w Szkole Zdrowia Publicznego Uniwersytetu Harvarda. Wykorzystując modele komórkowe i zwierzęce, naukowcy zbadali rolę enzymów acylotransferazy diglicerydów(odnośnik otworzy się w nowym oknie), które katalizują ostateczny krok w syntezie TG Zaawansowane techniki molekularne i farmakologiczna inhibicja lub genetyczna utrata funkcji DGAT wykazały, że zmniejszone magazynowanie TG skutkuje osłabieniem syntezy kwasów tłuszczowych. Zjawisko to jest prawdopodobnie regulowane przez białka wiążące czynnik regulujący sterole(odnośnik otworzy się w nowym oknie) (ang. sterol regulatory element-binding proteins, SREBP) – czynniki transkrypcyjne kontrolujące ekspresję genów zaangażowanych w syntezę lipidów. Inhibicja DGAT2 bezpośrednio wpływała na poziom i aktywność SREBP i genów zaangażowanych w biosyntezę lipidów.
Znaczenie kliniczne projektu TGDNL i perspektywy na przyszłość
„Nasze ustalenia potwierdzają istnienie uniwersalnego mechanizmu zwrotnego, w ramach którego komórkowe magazynowanie lipidów kontroluje syntezę kwasów tłuszczowych, dostarczając istotnych informacji na temat mechanizmów regulacyjnych homeostazy lipidów komórkowych”, podkreśla Rydén. Wiedza ta może pomóc w opracowaniu skutecznych farmakoterapii przeciwko NAFLD, co jest niezwykle ważne, ponieważ obecnie nie istnieją żadne skuteczne metody leczenia NAFLD poza zmianą stylu życia, która może poprawić sprawność fizyczną i przyczynić się do utraty wagi. Wyjaśnienie znaczenia patofizjologicznego mechanizmów odkrytych podczas projektu TGDNL, szczególnie roli DGAT i SREBP w najczęściej spotykanych chorobach metabolicznych, wymaga jednak dalszych badań. W tym celu naukowcy planują przeanalizować różne dane omiczne, a następnie powiązać je z funkcjonalnymi fenotypami tkanki tłuszczowej i wątroby otyłych pacjentów, zarówno tych cierpiących na cukrzycę typu 2 lub zespół metaboliczny, jak i tych niedotkniętych tymi chorobami.